Le PREMIER ET SEUL fer i.v. au Canada indiqué à la fois chez les adultes et chez les enfants ayant une anémie ferriprive, ainsi que chez les adultes atteints d’une insuffisance cardiaque (classe II/III de la NYHA) s’accompagnant d’une carence en fer*,1,2


Voici FERINJECT
MD
(carboxymaltose ferrique)
FerinjectMD (carboxymaltose ferrique) est indiqué1 :
- Pour le traitement de l’anémie par carence en fer (anémie ferriprive) chez les adultes et les enfants de 1 an et plus lorsque les préparations orales de fer ne sont pas tolérées ou sont inefficaces.
- Pour le traitement de la carence en fer chez les adultes atteints d’insuffisance cardiaque de classe II ou III de la NYHA afin d’améliorer la capacité à l’effort.
Le diagnostic de carence en fer doit reposer sur des analyses de laboratoire1.
i.v. : intraveineux; NYHA : New York Heart Association
* La portée clinique des données comparatives n’a pas été établie.
Références : 1. Monographie de FerinjectMD. Vifor (International) Inc. 27 juin 2024. 2. CSL Vifor Canada. Lettre d’attestation A : Seule et unique revendication. 9 avril 2025.
Trouvez une clinique de perfusion pouvant faire les injections de FerinjectMD près de votre pratique.
Données sur la carence en fer en présence d’IC
Données sur l’efficacité et l’innocuité démontrées chez les patients atteints d’une ICC (classe II ou III de la NYHA) s’accompagnant d’une carence en fer
FerinjectMD a entraîné une amélioration significative de la tolérance à l’effort chez les patients atteints d’une ICC s’accompagnant d’une carence en fer par comparaison au placebo (d’après la variation moyenne [MC] des résultats au TM6 entre le début de l’étude et la semaine 24 : 17,5 m c. -15,7 m; p = 0,002; critère d’évaluation principal)1,2
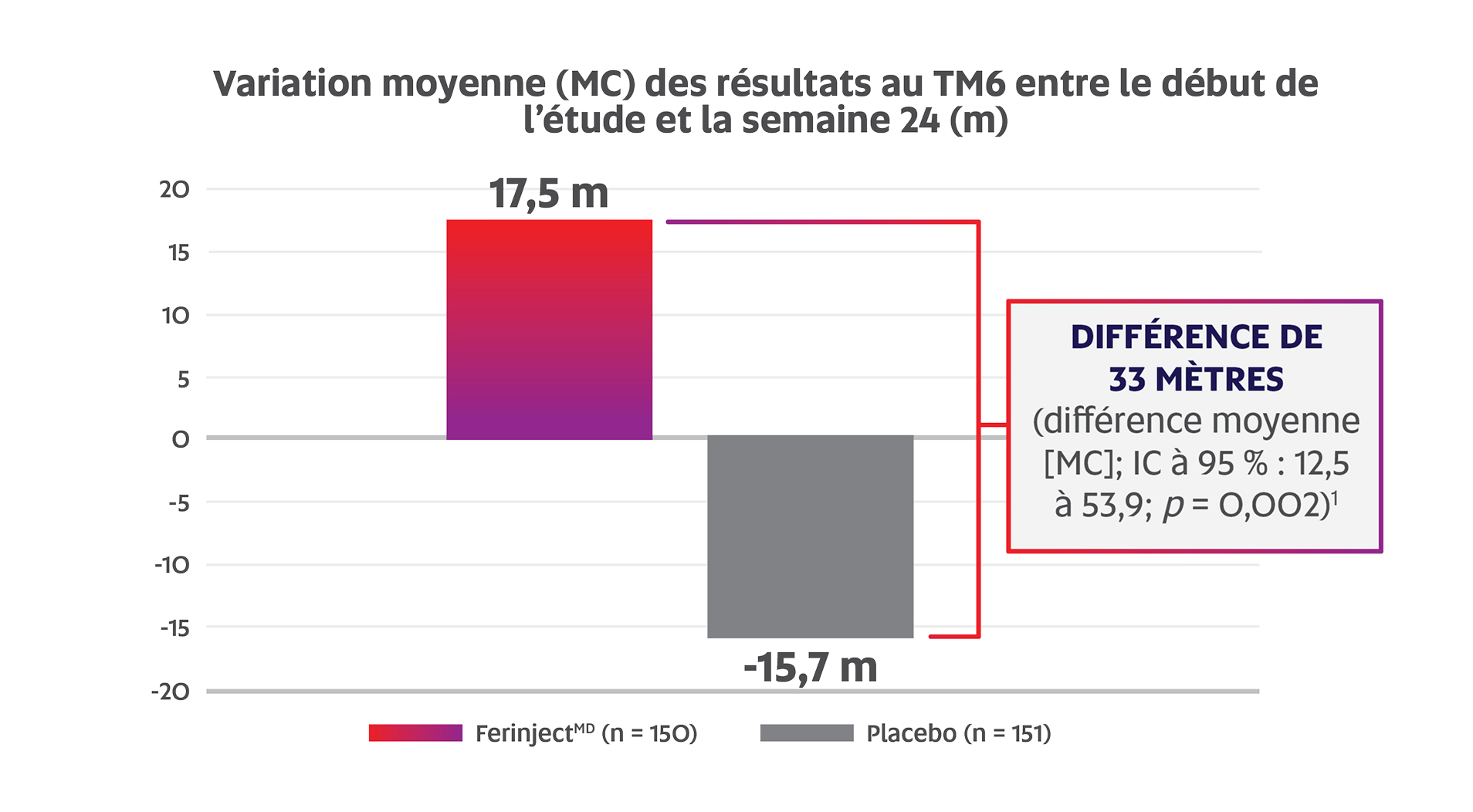
Adaptation de la monographie de FerinjectMD1
À propos du test de marche de 6 minutes (TM6)

Le TM6 permet d’évaluer la distance parcourue (au mètre près) en 6 minutes2 :
- Tous les tests ont été effectués le long d’un couloir rectiligne, plat et dur d’une longueur d’au moins 25 m. Une chaise est placée à chaque extrémité du parcours pour marquer l’endroit où le patient doit faire demi-tour.
- Les patients devaient marcher le long du couloir à leur propre rythme et essayer de parcourir la plus grande distance possible.
- Les patients pouvaient s’asseoir sur les chaises pour se reposer durant le test, mais on les encourageait à recommencer à marcher dès qu’ils se sentaient physiquement capables de le faire.
- On conseillait aux patients de prendre un petit repas et d’éviter les activités vigoureuses dans les 2 heures précédant le test.
Effets indésirables signalés chez ≥ 2 % des patients atteints d’ICC ayant reçu FerinjectMD et plus souvent que chez les patients ayant reçu le placebo1

Adaptation de la monographie de FerinjectMD1
* Les termes bradycardie sinusale, mort subite cardiaque, vomissements, bouffées vasomotrices, douleurs aux extrémités et dyspnées
regroupent plusieurs termes qui sont quasi-synonymes.
† Les termes qui regroupent des événements cliniques distincts sont les suivants : douleur thoracique (angine de poitrine); douleur abdominale
(distension abdominale); fatigue (malaise, maladie, inconfort); réactions au point d’injection ou de perfusion (extravasation, hématome,
hématome postopératoire, réaction locale); fracture (fracture de hanche, fracture des côtes, fracture de compression rachidienne); maux de tête
(migraine, migraine avec aura); étourdissements (vertiges, trouble de l’équilibre); éruptions cutanées (exanthème, urticaire, prurit, exanthème de
Boston); hypertension (crise hypertensive).
Dans l’étude sur l’insuffisance cardiaque (CONFIRM-HF), l’ensemble des patients avaient de 35 à 88 ans1.
Plan de l’étude CONFIRM-HF (cardiologie)
Étude de phase 4, à double insu, à répartition aléatoire, contrôlée contre placebo visant à déterminer l’effet de FerinjectMD sur la tolérance à l’effort chez des patients atteints d’une ICC s’accompagnant d’une carence en fer1
Critère d’évaluation principal : variation des résultats au test de marche de 6 minutes (TM6) après 24 semaines1
- La dose administrée au jour 1 et à la semaine 6 était établie d’après le tableau de détermination de dose simplifié, selon le taux d’Hb et le poids corporel à la sélection1.
- Des doses supplémentaires étaient administrées aux semaines 12, 24 et 36 uniquement si le taux de ferritine sérique était < 100 ng/mL ou de 100 à 300 ng/mL accompagné d’un CST < 20 %1.
- L’âge moyen se chiffrait à 68,9 ans dans le groupe traité par FerinjectMD (tranche d’âge : de 43 à 86 ans) et à 69,4 ans dans le groupe placebo (tranche d’âge : de 35 à 88 ans)1.
Références & notes de bas de page
CST : coefficient de saturation de la transferrine; FEVG : fraction d’éjection du ventricule gauche; Hb : hémoglobine; IC : intervalle de confiance; ICC : insuffisance cardiaque chronique; i.v. : intraveineux; MC : moindres carrés; MedDRA : Medical Dictionary for Regulatory Activities; NYHA : New York Heart Association
‡ Étaient admis dans l’étude des patients présentant des symptômes légers ou modérés malgré l’optimisation du
traitement pharmacologique et un taux de ferritine sérique < 100 ng/mL (ou de 100 à 300 ng/mL accompagné d’un
CST < 20 %). Le taux d’Hb moyen au début de l’étude était de 12 g/dL. Étaient exclus les patients dont le taux d’Hb
était ≥ 15 g/dL au début de l’étude1.
§ Les patients étaient stratifiés selon leurs taux d’Hb à la sélection1.
Références
- Monographie de FerinjectMD. Vifor (International) Inc. 27 juin 2024.
- Ponikowski P, van Veldhuisen DJ, Comin-Colet J, et al. Beneficial effects of long-term intravenous iron therapy with ferric carboxymaltose in patients with symptomatic heart failure and iron deficiency. Eur Heart J. 2015;36:657-668.
Données sur l’anémie ferriprive
Profils d’efficacité et d’innocuité démontrés dans plusieurs domaines thérapeutiques1
Explorez les données cliniques qui suivent1 :

dans les 10 jours suivant l’accouchement
Les cinq essais cliniques pivots sur l’utilisation de FerinjectMD dans le traitement de l’anémie ferriprive étaient des essais en mode ouvert, à répartition aléatoire, contrôlés contre témoin actif. Cliquez sur les liens ci-dessus afin d’accéder aux pages individuelles pour obtenir plus d’information sur le plan, les critères d’évaluation et les résultats de chaque étude1.
Références & notes de bas de page
Référence
- Monographie de FerinjectMD. Vifor (International) Inc. 27 juin 2024.
Posologie et administration
La dose de FerinjectMD est établie par étapes1
FerinjectMD est destiné à une utilisation i.v. seulement. FerinjectMD peut être administré1 :

par perfusion, après sa dilution dans une solution stérile de chlorure de sodium à 0,9 %

par injection, sans dilution

lors d’une séance d’hémodialyse, sans dilution, directement dans la tubulure veineuse du dialyseur
FerinjectMD ne doit pas être administré par voie sous-cutanée ou intramusculaire1.
- La posologie de FerinjectMD est exprimée en mg de fer élémentaire1 :
- 1 mL de FerinjectMD = 50 mg de fer élémentaire
- Les fioles sont offertes dans les formats suivants : 100 mg/2 mL, 500 mg/10 mL et 1000 mg/20 mL*,1.
Pour en savoir plus sur :
Références & notes de bas de page
i.v. : intraveineux
* Une inspection visuelle des fioles doit être faite avant l’utilisation pour détecter tout indice de sédimentation ou de
bris. Utiliser uniquement les fioles renfermant une dispersion homogène sans sédimentation1.
Référence
- Monographie de FerinjectMD. Vifor (International) Inc. 27 juin 2024.
Posologie et administration
Dose recommandée chez les adultes
Déterminer les besoins individuels en fer d’un adulte1
Déterminez la quantité de fer totale requise à l’aide du tableau ci-dessous en tenant compte du poids corporel de votre patient et de son taux d’hémoglobine (Hb) actuel1.
Adaptation de la monographie de FerinjectMD1
Calculer et administrer la dose individuelle maximale de fer1
D’après les besoins totaux en fer déterminés à l’étape 1, administrez la dose appropriée de FerinjectMD. N’oubliez pas qu’une administration unique de FerinjectMD chez les adultes ne doit pas dépasser1 :
15 mg
de fer/kg de
poids corporel
1000 mg
de fer
(20 mL de FerinjectMD)
La dose cumulative maximale recommandée est de 1000 mg de fer (20 mL de FerinjectMD) par semaine. Si les besoins totaux en fer sont plus élevés, l’administration de chaque dose supplémentaire doit se faire à intervalle d’au moins sept jours1.

PATIENTS ATTEINTS D’UNE MRC-HD
Chez les adultes atteints de maladie rénale chronique exigeant un traitement par hémodialyse, il ne faut pas dépasser une dose unique quotidienne maximale de 200 mg de fer1.

FEMMES ENCEINTES
Le traitement par FerinjectMD ne doit être utilisé qu’à partir de la 16e semaine de grossesse, et ce, seulement si les bienfaits du traitement l’emportent sur les risques pour la mère et le fœtus. La dose maximale cumulative se limite à 1000 mg pour les femmes enceintes dont les taux d’Hb sont > 90 g/L et à 1500 mg pour celles dont les taux d’Hb sont ≤ 90 g/L. N’administrez pas plus de 1000 mg de fer par semaine1.
Réévaluer après l’administration de fer1
Le clinicien doit effectuer une autre évaluation selon l’état de santé du patient1.
Réévaluez les taux d’hémoglobine (Hb) lorsqu’au moins quatre semaines se sont écoulées depuis l’administration de la dernière dose de FerinjectMD pour laisser un délai adéquat à l’érythropoïèse et à l’utilisation du fer. Si une administration supplémentaire de fer est requise, retournez à l’étape 11.
Références & notes de bas de page
MRC-HD : maladie rénale chronique exigeant un traitement par hémodialyse
Référence
- Monographie de FerinjectMD. Vifor (International) Inc. 27 juin 2024.
À propos de FerinjectMD
Un fer i.v. possédant une expérience mondiale*,1,2
PLUS DE
17
ans sur le marché mondial2
PLUS DE
30
millions d’années-patients d’expérience2
Présent dans
87
pays2
Fabriqué par
Vifor
(International) AG2
A fait l’objet d’études dans plusieurs domaines thérapeutiques, notamment en1 :

Cardiologie
Voir les données
Santé de la femme
Voir les données
Néphrologie
Voir les données
Gastro-entérologie
Voir les donnéesLe PREMIER ET SEUL fer i.v. au Canada indiqué chez tous les types de patients suivants†,1,2 :

Adultes atteints d’une insuffisance cardiaque (de classe II ou III de la NYHA) s’accompagnant d’une carence en fer
+

Adultes atteints d’anémie ferriprive
+

Enfants (1 an et +) atteints d’anémie ferriprive
Mode d’action*
Dispersion colloïdale de carboxymaltose ferrique*,1
FerinjectMD contient un complexe de fer composé d’un noyau d’hydroxyde de fer polynucléaire et d’un ligand glucidique1.
Conçu pour fournir du fer permettant le transport et le stockage du fer*,1
Transferrine

Ferritine
Les différents complexes de fer i.v. ne sont pas interchangeables sur le plan clinique parce que leur structure n’est pas la même, ce qui influence leurs profils pharmacocinétiques1.
Références & notes de bas de page
i.v. : intraveineux; NYHA : New York Heart Association
* La portée clinique n’a pas été établie.
† La portée clinique des données comparatives n’a pas été établie.
Références
- Monographie de FerinjectMD. Vifor (International) Inc. 27 juin 2024.
- CSL Vifor Canada. DoF_Attestation Letter-A_First and Only Claim_9April2025 et CSL Vifor Canada_DoF_Attestation Letter-B_Worldwide Experience Claim_2025.
Données sur l’anémie ferriprive
Données sur l’efficacité démontrée chez les femmes en postpartum atteintes d’anémie ferriprive
Un nombre significativement plus élevé de femmes en postpartum ont atteint un taux d’Hb > 120 g/L avec FerinjectMD qu’avec le fer oral entre le début de l’étude et le jour 42 (91,4 % c. 66,7 %; p < 0,0001; critère d’évaluation principal)*,1,2
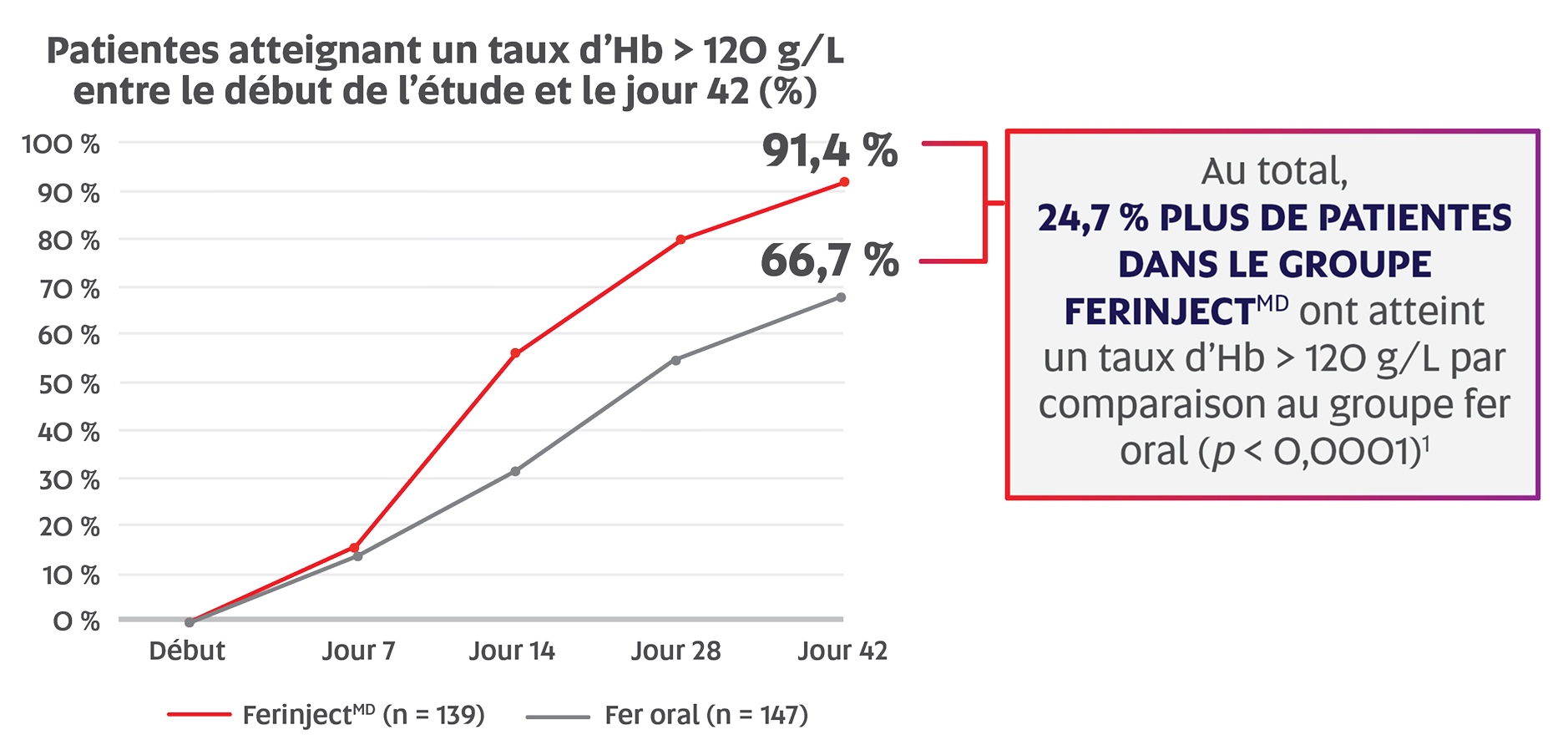
Adaptation de Seid MH, et al.2
Plan de l’étude 1VIT06011 (santé de la femme)
Étude de phase 3 en mode ouvert, à répartition aléatoire, contrôlée contre témoin actif comparant FerinjectMD et le fer oral1
Critère d’évaluation principal : proportion de patientes atteignant un taux d’Hb > 120 g/L à n’importe quel moment entre le début et la fin de l’étude (jour 42)1
Les patientes étaient réparties aléatoirement et stratifiées selon les critères suivants1 :
- taux d’Hb au départ
- taux de ferritine au moment de la sélection
- nécessité d’effectuer une césarienne
Références & notes de bas de page
Hb : hémoglobine
* Le taux d’Hb moyen au début de l’étude était de 8,9 g/L1.
† La dose de FerinjectMD était déterminée selon la carence en fer calculée à l’aide d’un tableau simplifié et du poids
avant la grossesse1.
Références
- Monographie de FerinjectMD. Vifor (International) Inc. 27 juin 2024.
- Seid MH, Derman RJ, Baker JB, et al. Ferric carboxymaltose injection in the treatment of postpartum iron deficiency anemia: a randomized controlled clinical trial. Am J Obstet Gynecol. 2008;199:435.e1-7.
Données sur l’anémie ferriprive
Données sur l’efficacité démontrée chez les patients atteints d’anémie ferriprive et de MRC-NHD
FerinjectMD à dose élevée a significativement retardé l’atteinte du critère principal d’évaluation par rapport au fer oral chez les patients atteints d’une MRC-NHD (RRI : 0,65; IC à 95 % : 0,44 à 0,95; p = 0,026)1,2
Critère d’évaluation principal : délai avant l’instauration d’un traitement supplémentaire de l’anémie ou un changement de traitement ou deux valeurs d’Hb < 10 g/L consécutives (sans hausse du taux d’Hb ≥ 5 g/L entre la mesure des deux valeurs)1
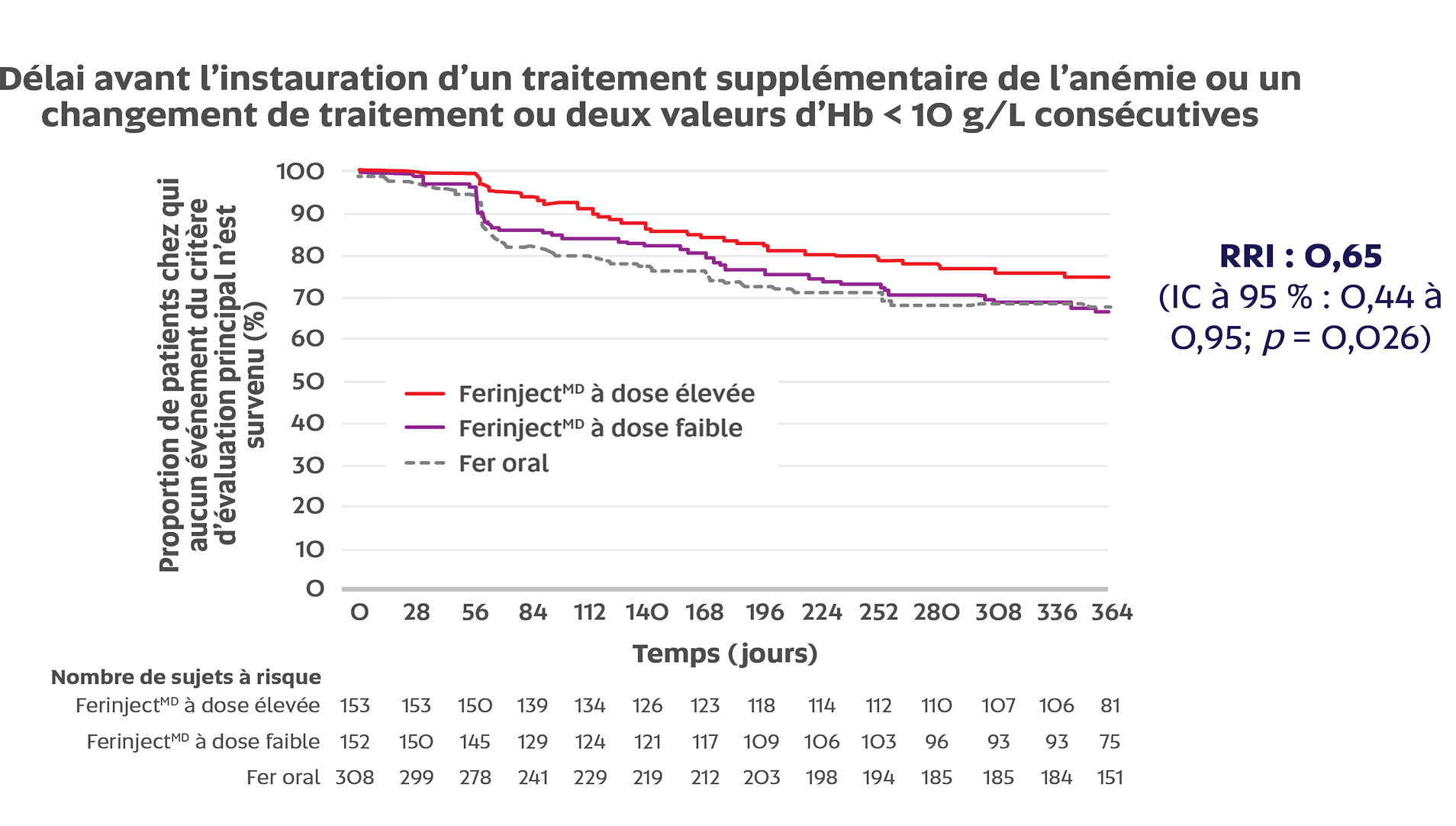
Adaptation de Macdougall IC, et al.2
Plan de l’étude FIND-CKD (néphrologie)
Étude de phase 3b en mode ouvert, à répartition aléatoire, de détermination des doses, contrôlée contre témoin actif comparant FerinjectMD et le fer oral1
Critère d’évaluation principal : délai avant l’instauration d’un traitement supplémentaire de l’anémie ou un changement de traitement ou deux valeurs d’Hb < 10 g/L consécutives (sans hausse du taux d’Hb ≥ 5 g/L entre la mesure des deux valeurs)1
- Âge moyen (tranche d’âge)1 :
- 69,5 ans (de 23 à 92 ans) dans le groupe FerinjectMD à dose élevée
- 68,1 (de 29 à 88 ans) dans le groupe FerinjectMD à dose faible
- 69,3 ans (de 18 à 96 ans) dans le groupe fer oral
- La comparaison entre les deux groupes FerinjectMD n’était pas assez puissante pour atteindre une différence statistiquement significative1.
Données sur l’efficacité démontrée chez les patients sous hémodialyse atteints d’anémie ferriprive associée à une MRC
Pourcentage de patients présentant une MRC-HD ayant atteint une hausse du taux d’Hb ≥ 10 g/L quatre semaines après le début de l’étude dans le groupe FerinjectMD par rapport au groupe fer-saccharose i.v. (46,4 % c. 37,2 %; p = 0,2101; critère d’évaluation principal)†,1
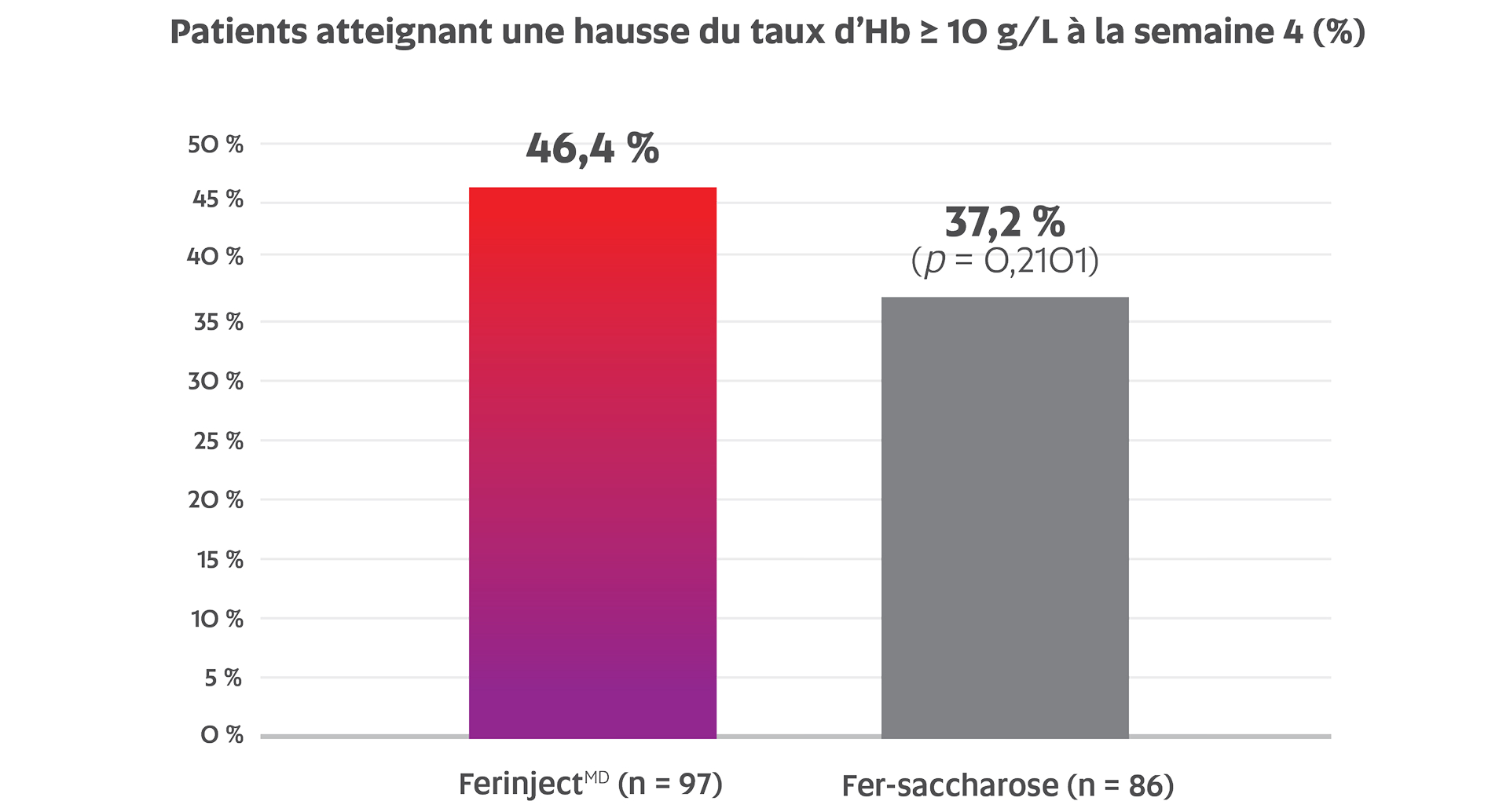
Adaptation de la monographie de FerinjectMD1
Remarque : Les données sont fournies à des fins de comparaison descriptive seulement. Aucune analyse statistique formelle n’était prévue dans le cadre de cette étude pour effectuer une comparaison directe de FerinjectMD et du fer-saccharose1.
Plan de l’étude VIT-IV-CL-015 (néphrologie)
Étude de phase 3 en mode ouvert, à répartition aléatoire, contrôlée contre témoin actif comparant FerinjectMD et le fer-saccharose i.v.1
Critère d’évaluation principal : pourcentage de patients de la population conforme au protocole atteignant une hausse du taux d’Hb ≥ 10 g/L quatre semaines après le début de l’étude1
- Le traitement était poursuivi dans les deux groupes jusqu’à l’atteinte de la dose cumulative de fer calculée individuellement§,1.
- La dose cumulative moyenne de fer sous forme de FerinjectMD était de 1700 mg1.
- L’âge moyen était de 52,6 ans dans le groupe FerinjectMD (tranche d’âge : 22 à 80 ans) et de 51,0 ans dans le groupe fer-saccharose i.v. (tranche d’âge : 22 à 79 ans)1.
Remarque : Les données sont fournies à des fins de comparaison descriptive seulement. Aucune analyse statistique formelle n’était prévue dans le cadre de cette étude pour effectuer une comparaison directe de FerinjectMD et du fer-saccharose1.
Références & notes de bas de page
CST : coefficient de saturation de la transferrine; DFGe : débit de filtration glomérulaire estimé; Hb : hémoglobine;
IC : intervalle de confiance; i.v. : intraveineux; MRC : maladie rénale chronique; MRC-HD : maladie rénale chronique exigeant un traitement par hémodialyse; RRI : rapport des risques instantanés
* Étaient admis à cette étude des patients ayant un taux d’Hb de 90 à 110 g/L et un taux de ferritine sérique < 100 ng/mL ou < 200 ng/mL et un CST < 20 %, qui ne recevaient pas d’agent stimulant l’érythropoïèse1.
† Le taux d’Hb moyen au début de l’étude était de 93,6 g/L1.
‡ Les patients avaient un taux d’Hb ≤ 115 g/L et un CST < 20 % ou un taux de ferritine sérique < 200 ng/mL, avec ou sans traitement par érythropoïétine1.
§ Les besoins en fer totaux cumulatifs ont été calculés à l’aide de la formule de Ganzoni1.
Références
- Monographie de FerinjectMD. Vifor (International) Inc. 27 juin 2024.
- Macdougall IC, Bock AH, Carrera F, et al. FIND-CKD: a randomized trial of intravenous ferric carboxymaltose versus oral iron in patients with chronic kidney disease and iron deficiency anaemia. Nephrol Dial Transplant. 2014;29:2075-2084.
Données sur l’anémie ferriprive
Données sur l’efficacité démontrée chez les patients atteints d’anémie ferriprive et de MII chronique : résultats en comparaison avec le fer-saccharose i.v.
Un nombre significativement plus élevé de patients atteints d’une MII chronique ont répondu au traitement par FerinjectMD par rapport au fer-saccharose i.v. à la semaine 12 (65,8 % c. 53,6 %; p = 0,004; critère d’évaluation principal)*,1
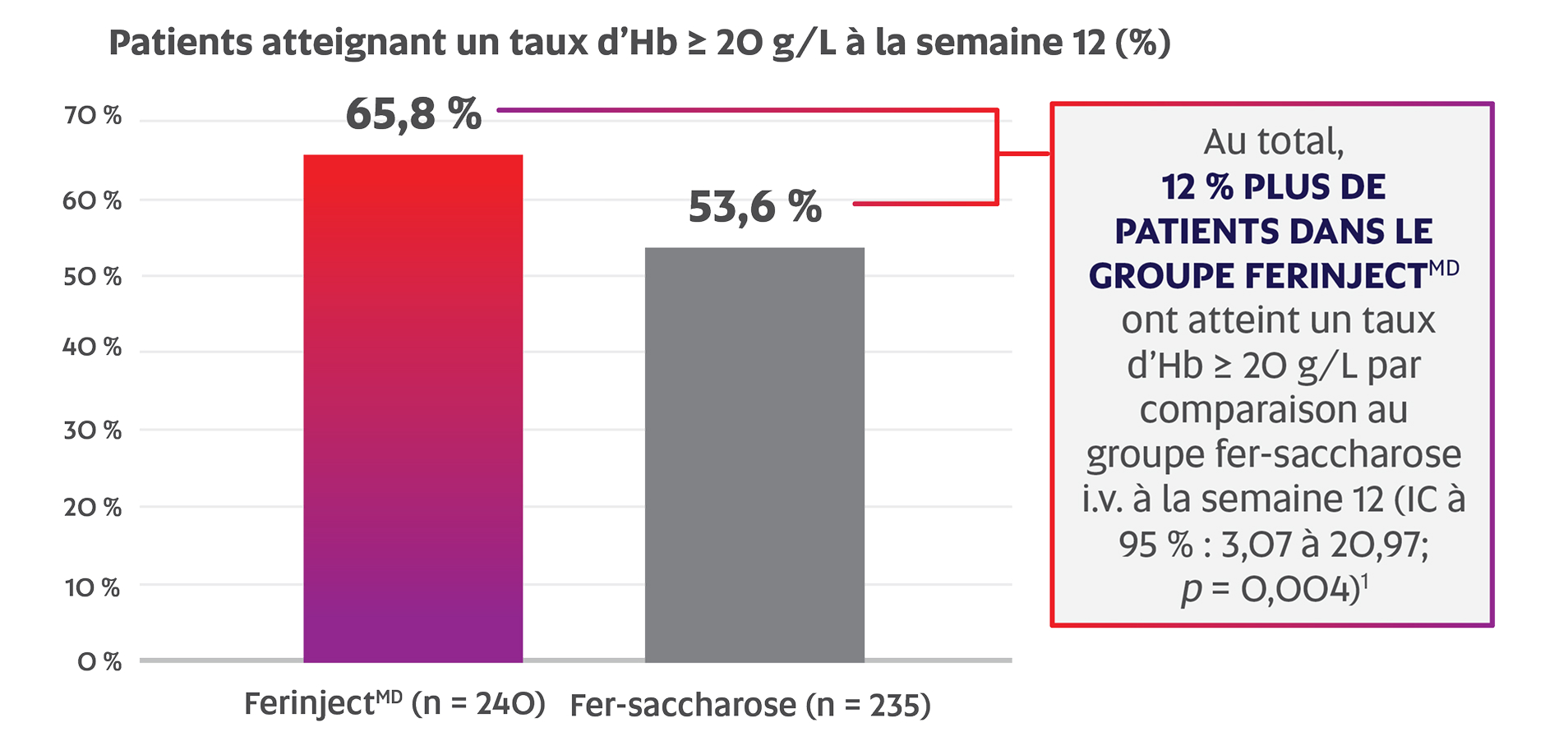
Adaptation de la monographie de FerinjectMD1
Plan de l’étude FERGIcor (gastro-entérologie)
Étude de phase 3 en mode ouvert, à répartition aléatoire, contrôlée contre témoin actif comparant un schéma posologique simplifié de FerinjectMD à des doses de fer-saccharose i.v. calculées de manière individuelle1
Critère d’évaluation principal : nombre de répondeurs, définis comme des patients atteignant une hausse ≥ 20 g/L du taux d’Hb à la semaine 121
- Au total, 35,2 % des patients du groupe FerinjectMD avaient la maladie de Crohn (c. 31,0 % des patients du groupe fer-saccharose i.v.)1.
- Au total, 64,8 % des patients du groupe FerinjectMD avaient une colite ulcéreuse (c. 69,0 % des patients du groupe fer-saccharose i.v.)1.
- L’âge moyen se chiffrait à 39,7 ans dans le groupe FerinjectMD (tranche d’âge : de 18 à 81 ans) et 39,6 ans dans le groupe fer-saccharose i.v. (tranche d’âge : de 18 à 78 ans)1.
Données sur l’efficacité démontrée chez les patients atteints d’anémie ferriprive et de MII chronique : résultats en comparaison avec le fer oral
FerinjectMD s’est avéré non inférieur au fer oral chez les patients atteints d’une MII d’après la variation moyenne du taux d’Hb entre le début de l’étude et la semaine 12 (38,3 g/L c. 37,5 g/L; p = 0,8016; critère d’évaluation principal)‡,§,1
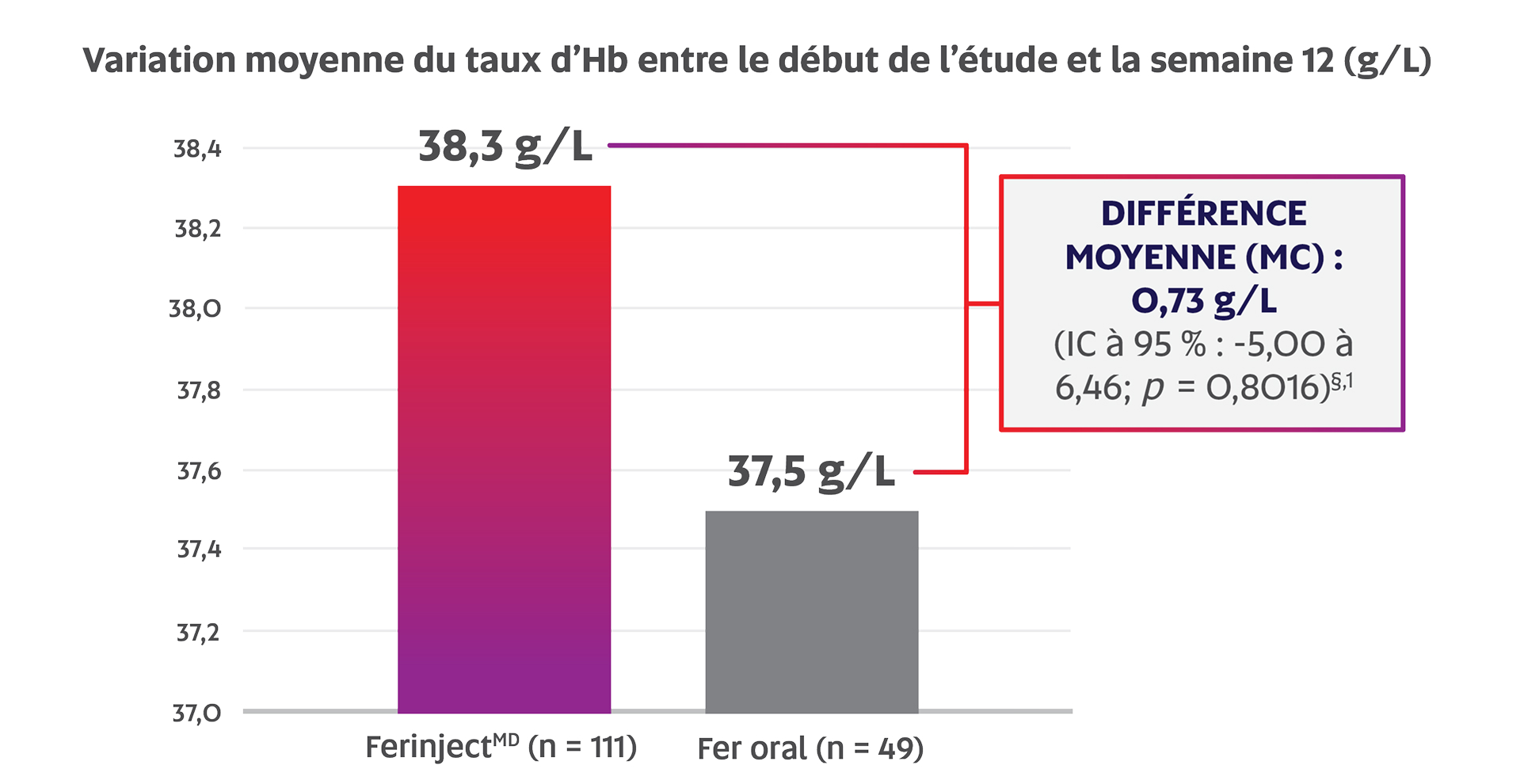
Adaptation de la monographie de FerinjectMD1
Plan de l’étude VIT-IV-CL-008 (gastro-entérologie)
Étude de phase 3 de non-infériorité en mode ouvert, à répartition aléatoire, contrôlée contre témoin actif comparant FerinjectMD au fer oral1
Critère d’évaluation principal : variation du taux d’Hb entre le début de l’étude et la semaine 121
- Au total, 27,9 % des patients du groupe FerinjectMD avaient la maladie de Crohn (c. 26,5 % dans le groupe fer oral)1.
- Au total, 72,1 % des patients du groupe FerinjectMD avaient la colite ulcéreuse (c. 73,5 % dans le groupe fer oral)1.
- L’âge moyen était de 40,7 ans dans le groupe FerinjectMD (tranche d’âge : 19 à 78 ans) et de 45,2 ans dans le groupe fer oral (tranche d’âge : 20 à 78 ans)1.
Références & notes de bas de page
CST : coefficient de saturation de la transferrine; Hb : hémoglobine; IC : intervalle de confiance; i.v. : intraveineux;
MC : moindres carrées; MII : maladie inflammatoire de l’intestin
* La réponse était définie comme l’atteinte d’un taux d’Hb ≥ 20 g/L à la semaine 12. Le taux d’Hb moyen au début de
l’étude était de 10,2 g/L1.
† Étaient inclus dans l’étude les patients ayant un taux d’Hb de 70 à 120 g/L (femmes) ou de 70 à 130 g/L (hommes) et
un taux de ferritine sérique < 100 ng/mL. Les besoins en fer étaient calculés à l’aide de la formule de Ganzoni1.
‡ Le taux d’Hb moyen au début de l’étude était de 86,2 g/L1.
§ La limite inférieure de l’IC à 95 % concernant la différence des variations du taux d’Hb entre les traitements était de
-5,0 g/L; par conséquent, la non-infériorité a été établie1.
¶ Étaient admis à cette étude des patients ayant un taux d’Hb ≤ 110 g/L et un CST < 20 % ou un taux de ferritine sérique < 100 ng/mL dont les besoins en fer calculés étaient d’au moins 1000 mg d’après la formule de Ganzoni1.
Référence
- Monographie de FerinjectMD. Vifor (International) Inc. 27 juin 2024.
Données sur l’anémie ferriprive
Profil d’innocuité démontré chez les patients atteints d’anémie ferriprive
Résultats dans la population groupée de l’analyse de l’innocuité effectuée auprès de 2 196 adultes et dans plusieurs domaines thérapeutiques1
- EIT (toutes causes confondues) : 42,4 % (932 patients)
- Les effets indésirables les plus fréquemment signalés (≥ 2 %) ont été les suivants : maux de tête, œdème, hypertension, réactions au site d’injection ou de perfusion, éruption cutanée, arthralgie, infections des voies urinaires, étourdissements, nausées, rhinopharyngite et diarrhée.
- EIG (toutes causes confondues) : 6,0 % (131 patients)
- Aucun EIG n’a été signalé chez > 1 % des patients dans le groupe FerinjectMD.
- Les seuls EIG signalés dans le groupe FerinjectMD étaient la pyrexie, les maux de tête et l’embolie pulmonaire. Chacun de ces EIG a été signalé par un patient.
- Abandons attribuables à des EIT : 0,3 % (6 EIT)
- Parmi les EIT signalés, 0,5 % ont causé le décès, mais aucun d’eux n’a été considéré comme associé à FerinjectMD.
Effets indésirables signalés chez ≥ 1 % des adultes ayant reçu FerinjectMD1
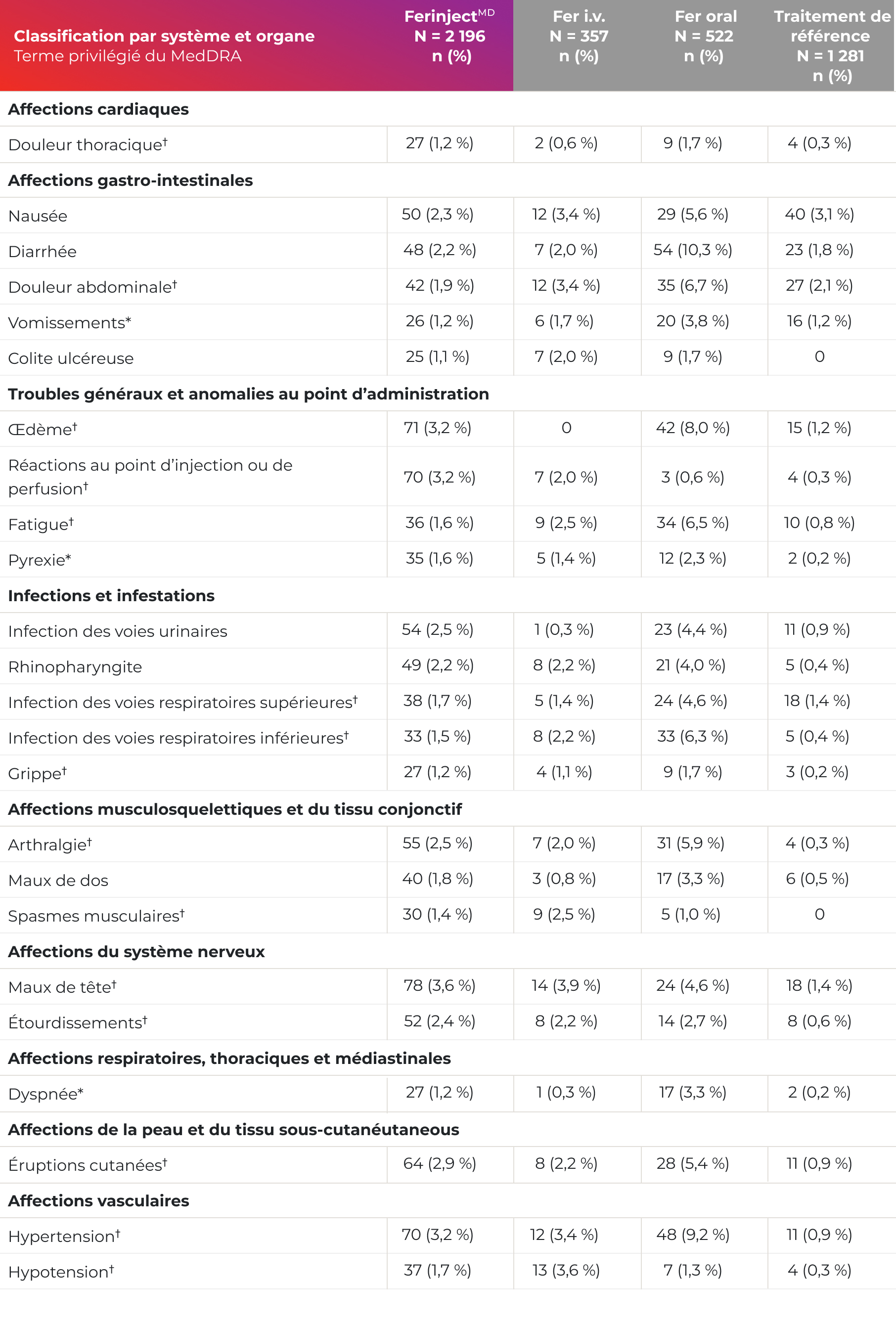
Adaptation de la monographie de FerinjectMD1
i.v. : intraveineux; MedDRA : Medical Dictionary for Regulatory Activities
* Les termes vomissements, pyrexie et dyspnée regroupent plusieurs termes qui sont quasi-synonymes.
† Les termes qui regroupent des événements cliniques distincts sont les suivants : douleur thoracique (angine de poitrine); douleur abdominale (distension
abdominale); œdème (enflure périphérique); réactions au point d’injection ou de perfusion (extravasation, hématome, hématome postopératoire, réaction
locale); fatigue (malaise, maladie, inconfort); infection des voies respiratoires supérieures (rhinite, sinusite); infection des voies respiratoires inférieures
(bronchite, pneumonie); grippe (syndrome pseudo-grippal); arthralgie (raideur articulaire, enflure articulaire); spasmes musculaires (raideur
musculosquelettique); maux de tête (migraine, migraine avec aura); étourdissements (vertiges, trouble de l’équilibre); éruptions cutanées (exanthème,
urticaire, prurit, exanthème de Boston); hypertension (crise hypertensive); hypotension (pression artérielle anormale, hypotension due à la dialyse).
La fréquence des effets indésirables survenus au cours du traitement chez les enfants (de 1 à 17 ans) était comparable à celle de l’ensemble de la population à l’étude‡,1
- EIT (toutes causes confondues) : 35 %
- EIT les plus fréquemment signalés (≥ 5 %) : hypophosphatémie, éruption cutanée, réaction au site d’injection ou de perfusion, maux de tête et vomissements.
- Aucun EIG chez les enfants
- Un EIT entraînant l’abandon du traitement (douleur au point d’injection)
- Aucun EIT nouveau ou imprévu n’a été observé chez les enfants par comparaison à ceux qui ont été signalés chez les adultes.
Effets indésirables signalés chez ≥ 1 % des enfants ayant reçu FerinjectMD1
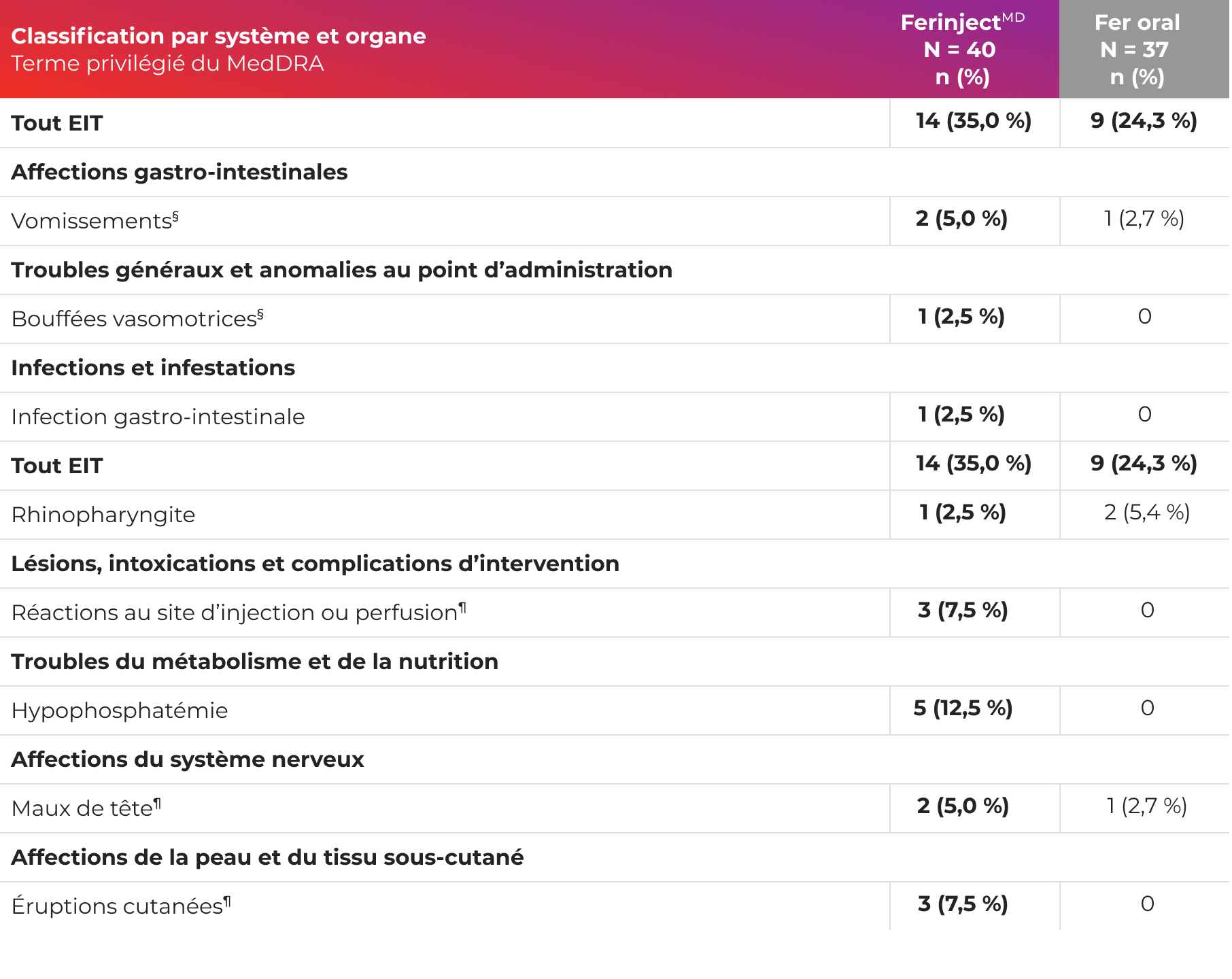
Adaptation de la monographie de FerinjectMD1
EIT : effet indésirable survenu pendant le traitement; MedDRA : Medical Dictionary for Regulatory Activities
§ Les termes vomissements et bouffées vasomotrices regroupent plusieurs termes qui sont quasi-synonymes.
¶ Les termes qui regroupent des événements cliniques distincts sont les suivants : réactions au point d’injection
ou perfusion (extravasation, hématome, hématome postopératoire, réaction locale); maux de tête (migraine,
migraine avec aura); éruptions cutanées (exanthème, urticaire, prurit, exanthème de Boston).
Références & notes de bas de page
EI : effets indésirables; EIG : effets indésirables graves survenus pendant le traitement;
EIT : effets indésirables survenus pendant le traitement
‡ L’innocuité de FerinjectMD chez les enfants atteints d’anémie ferriprive a été évaluée dans le cadre d’une étude à répartition aléatoire, contrôlée contre témoin actif, menée auprès de 78 patients de 1 à 17 ans (âge médian : 14,5 ans). Quarante patients ont reçu 15 mg/kg de FerinjectMD jusqu’à concurrence d’une dose maximale unique de 750 mg les jours 0 et 7, pour obtenir une dose totale maximale de 1500 mg, et 38 patients ont reçu du sulfate ferreux oral pendant 28 jours1.
Référence
- Monographie de FerinjectMD. Vifor (International) Inc. 27 juin 2024.
Posologie et administration
Directives pour l’administration intraveineuse (i.v.)

Recommandations pour l’administration par perfusion i.v.1
Si vous administrez FerinjectMD par perfusion i.v., vous devez d’abord le diluer dans une solution stérile de chlorure de sodium à 0,9 %, puis l’administrer en suivant les recommandations ci-dessous1 :
Adaptation de la monographie de FerinjectMD1
- FerinjectMD doit être mélangé uniquement avec une solution stérile de chlorure de sodium à 0,9 %. Aucune autre solution pour dilution i.v. ni aucun autre agent thérapeutique ne doivent être utilisés en raison des risques de formation de précipité et/ou d’incompatibilité1.
- La préparation diluée de FerinjectMD pour perfusion i.v. doit être utilisée dans les 24 heures qui suivent la dilution si elle est conservée à une température de 2 à 8 °C1.
FerinjectMD ne doit pas être dilué à des concentrations inférieures à 2 mg de fer/mL (excluant le volume de la dispersion de FerinjectMD)1.
Recommandations pour l’administration par injection i.v.1
Si vous administrez FerinjectMD par injection i.v. en utilisant une dispersion non diluée, suivez les recommandations relatives aux vitesses d’administration dans le tableau ci-dessous1 :
Adaptation de la monographie de FerinjectMD1
La préparation non diluée de FerinjectMD pour injection i.v. doit être utilisée immédiatement après l’ouverture1.
FerinjectMD doit être administré seulement lorsque le personnel et les traitements nécessaires à la prise en charge de l’anaphylaxie et d’autres réactions d’hypersensibilité sont accessibles immédiatement. Il convient d’observer les patients afin de détecter tous signes et symptômes de réaction d’hypersensibilité, y compris la surveillance de la pression artérielle et du pouls, au cours de chaque perfusion de FerinjectMD et pendant au moins les 30 minutes qui suivent1.
Veuillez consulter la monographie de FerinjectMD pour obtenir les renseignements complets sur la posologie et l’administration.
Références & notes de bas de page
Référence
- Monographie de FerinjectMD. Vifor (International) Inc. 27 juin 2024.
Posologie et administration

Dose recommandée chez les enfants
Determiner les besoins individuels en fer d’un enfant1
Après avoir confirmé la carence en fer par des analyses de laboratoire, évaluez les besoins individuels en fer en fonction du poids corporel de votre patient et de son taux d’hémoglobine (Hb). Les besoins en fer de chaque patient doivent être calculés à l’aide de la formule de Ganzoni ou du tableau ci-dessous1.
Formule de Ganzoni
Calculez les besoins en fer et arrondissez à l’unité de 50 mg la plus proche à l’aide de la formule de Ganzoni1 :
Déficit total en fer (mg) =
poids corporel (kg) x (taux d’Hb cible – taux d’Hb réel) (g/dL) x 2,4 + réserves en fer (mg)
- Pour les patients pesant < 35 kg : utilisez les valeurs de 13 g/dL pour le taux cible d’Hb et de 15 mg/kg pour les réserves en fer1.
- Pour les patients pesant ≥ 35 kg :utilisez les valeurs de 15 g/dL pour le taux cible d’Hb et de 500 mg pour les réserves en fer1.
Tableau pour déterminer les besoins totaux en fer
Adaptation de la monographie de FerinjectMD1
Quelle que soit l’option utilisée pour calculer les besoins totaux en fer, la dose doit être arrondie à la tranche de 50 mg la plus près. La dose cumulative ne doit pas dépasser celles qui ont été établies à l’aide de la formule de Ganzoni ou celles qui figurent dans le tableau ci-dessus1.
Calculer et administrer la dose individuelle maximale de fer1
D’après les besoins totaux en fer déterminés à l’étape 1, administrez la dose appropriée de FerinjectMD. N’oubliez pas qu’une administration unique de FerinjectMD chez les enfants ne doit pas dépasser1 :
15 mg
de fer/kg
de poids corporel
750 mg
de fer
(15 mL
de FerinjectMD)
La dose cumulative maximale recommandée est de 750 mg de fer (15 mL de FerinjectMD) par semaine. Si les besoins totaux en fer sont plus élevés, l’administration de chaque dose supplémentaire doit se faire à intervalle d’au moins sept jours1.

PATIENTS ATTEINTS D’UNE MRC-HD
L’efficacité et l’innocuité de FerinjectMD n’ont pas été évaluées chez les enfants et les adolescents atteints de maladie rénale chronique exigeant un traitement par hémodialyse. L’utilisation de FerinjectMD n’est donc pas recommandée chez cette population de patients1.
Réévaluer après l’administration de fer1
Le clinicien doit effectuer une autre évaluation selon l’état de santé du patient1.
Réévaluez les taux d’hémoglobine (Hb) au moins quatre semaines après l’administration de la dernière dose de FerinjectMD pour laisser un délai adéquat à l’érythropoïèse et à l’utilisation du fer. Si une administration supplémentaire de fer est requise, déterminez à nouveau les besoins en fer en utilisant la formule de Ganzoni de l’étape 11.
Références & notes de bas de page
MRC-HD : maladie rénale chronique exigeant un traitement par hémodialyse
Référence
- Monographie de FerinjectMD. Vifor (International) Inc. 27 juin 2024.
Soutien et ressources
Ressources à télécharger utiles pour vous et vos patients

Guide pour les patients
Un guide convivial pour les patients canadiens à qui on a prescrit FerinjectMD
Télécharger PDF
Guide pour les professionnels de la santé
Un guide pour les professionnels de la santé et les autres membres de l’équipe de soins offrant des renseignements sur la posologie et l’administration de FerinjectMD, ainsi que des renseignements importants sur l’innocuité
Télécharger PDF
Monographie de FerinjectMD
Renseignements complets pour les professionnels de la santé et les patients
Télécharger PDFVous cherchez une clinique de perfusion où vos patients peuvent recevoir leur injection de FerinjectMD?
Soutien et ressources
Localisateur de clinique de perfusion
Vous êtes prêt à prescrire FerinjectMD? Trouvez une clinique de perfusion près de vous/de vos patients en entrant le code postal ci-dessous.
Trouvez une clinique de perfusion près de vous
Recherchez des cliniques dans votre région et visualisez-les sur une carte interactive.
Access Healthcare Services
2625 Queensview Dr, suit 105
Ottawa
Ontario
K2B 8K2
Insurance: accesshealthcaresevices
Bayshore Infusion Clinic - Calgary (South)
10233 Elbow Drive SW, Unit 125
Calgary
Alberta
T2W 1E8
Insurance: bayshore
Bayshore Infusion Clinic - Edmonton
10230 142nd Street NW, Suite 205
Edmonton
Alberta
T5N 3Y6
Insurance: bayshore
Bayshore - Fort McMurray
8106 Fraser Ave, Suite 55
Fort McMurray
Alberta
T9H 0G1
Bayshore Infusion Clinic - Grande Prairie
10104 97 Ave, Suite 201
Grande Prairie
Alberta
T8V 7X6
Bayshore - Medicine Hat
35 7th Street SE
Medicine Hat
Alberta
T1A 1J2
Bayshore Infusion Clinic - Red Deer
5201 43 Street
Red Deer
Alberta
T4N 1C7
Bayshore Infusion Clinic - Abbotsford
2051 McCallum Road
Abbotsford
British Colombia
V2S 3N5
Bayshore Infusion Clinic - Kelowna
3001 Tutt Street, Suite 210
Kelowna
British Colombia
V1Y 2H4
Bayshore Infusion Clinic - New Westminster
301 East Columbia Street, Suite 104
New Westminster
British Colombia
V3L 3W5
Bayshore Infusion Clinic - North Vancouver
135 East 15th Street
North Vancouver
British Colombia
V7L 2P7
Bayshore Infusion Clinic - Prince George
1100 Alward St
Prince George
British Colombia
V2M 7B1
Bayshore Infusion Clinic - Richmond
6051 Gilbert Road, Suite 301
Richmond
British Colombia
V7C 3V3
Bayshore Infusion Clinic - Surrey
13710 94A Avenue, Suite 307
Surrey
British Colombia
V3V 1N1
Bayshore Infusion Clinic - Vancouver
750 West Broadway
Vancouver
British Colombia
V5Z 1K1
Bayshore Infusion Clinic - Vernon
3310 32 Ave
Vernon
British Colombia
V1T 2M6
Bayshore Infusion Clinic - Victoria
1831 Oak Bay Ave
Victoria
British Colombia
V8R 1C3
Bayshore Infusion Clinic - Winnipeg
2265 Pembina Highway, Markham Professional Centre, Suite 207
Winnipeg
Manitoba
R3T 5J3
Bayshore Infusion Clinic - Fredericton
1015 Regent Street, Suite 500
Fredericton
New Brunswick
E3B 6H5
Bayshore Infusion Clinic - Saint John
560 Main St
Saint John
New Brunswick
E2K 1J5
Bayshore - Woodstock
100 Jones Street, Suite 102
Woodstock
New Brunswick
E7M 0H6
Bayshore - Bathurst ICN
515 Youghall Drive
Bathurst
New Brunswick
E2A 4X7
Bayshore - Moncton ICN
1116 Mountain Road
Moncton
New Brunswick
E1C 2T8
Bayshore Infusion Clinic - St. John's
9 Paton Street, Unit A
St.Johns
New Foundland and Labradour
A1B 4S8
Bayshore Infusion Clinic - Sydney
45 Weatherbee Road, Suite 403B Sydney Health Park
Sydney
Nova Scotia
B1M 0A1
Bayshore - Halifax ICN
7071 Bayers Rd
Halifax
Nova Scotia
B3L 2C2
Bayshore Infusion Clinic - Barrie
480 Huronia Road
Barrie
Ontario
L4N 6M2
Bayshore Infusion Clinic - Brampton
195 County Court Blvd
Brampton
Ontario
L6W 4P7
Bayshore Infusion Clinic - Guelph
89 Dawson Road, Guelph Medical Place, 1st floor
Guelph
Ontario
N1H 1B1
Bayshore Infusion Clinic - Hamilton
849 Upper Wentworth Street, Wentworth Limeridge Medical Centre, Suite 206B
Hamilton
Ontario
L9A 5H4
Bayshore Infusion Clinic - Kingston
724L Arlington Park Place
Kingston
Ontario
K7M 8H9
Bayshore Infusion Clinic - London
595 Bradley Avenue, Bradley Medical Centre, 2nd Floor
London
Ontario
N6E 3Z8
Bayshore Infusion Clinic - Markham
7800 Kennedy Rd.
Markham
Ontario
L3R 2C8
Bayshore Infusion Clinic - Toronto (Yonge)
4950 Yonge Street, Suite 908
North York
Ontario
M4S 6K1
Bayshore Infusion Clinic - Oakville
2525 Old Bronte Road, Palermo Professional Centre, Suite 210
Oakville
Ontario
L6M 4J2
Bayshore Infusion Clinic - Ottawa
117 Centrepointe Drive, Centrepointe Commerce Court, Suite 210
Ottawa
Ontario
K2G 5X3
Bayshore Infusion Clinic - Richmond Hill
9325 Yonge Street, South Hill Shopping Centre, Suite 8
Oakville
Ontario
L4C 0A8
Bayshore - Scarborough
520 Ellesmere Road, Suite 213
Scarborough
Ontario
M1R 0B1
Bayshore Infusion Clinic - Sudbury
2120 Regent Street
Sudbury
Ontario
P3E 3Z9
Bayshore Infusion Clinic - Timmins
119 Pine Street S, Suite 214
Timmins
Ontario
P4N 2K4
Bayshore Infusion Clinic - Toronto (Bloor)
2425 Bloor Street W, Toronto West Professional Centre, Suite 215
Toronto
Ontario
M6S 4W4
Bayshore Infusion Clinic - Windsor
700 Tecumseh Rd E, Windsor Health Centre, Suite 305
Windsor
Ontario
N8X 4T2
Bayshore - Burlington ICN
5045 Mainway
Burlington
Ontario
L7L 5Z1
Bayshore - Chatham ICN
20 Emma Street
Chatham
Ontario
N7L 5K5
Bayshore - Newmarket ICN
679 Davis Drive
Newmarket
Ontario
L3Y 5G8
Bayshore - Niagara Falls ICN
6453 Morrison St
Niagara Falls
Ontario
L2E 2G5
Bayshore - Orillia ICN
210 Memorial Ave
Orillia
Ontario
L3V 7V1
Bayshore - Owen Sound ICN
250 10th Street East
Owen Sound
Ontario
N4K 1S4
Bayshore - Sarnia ICN
265 Front Street North
Sarnia
Ontario
N7T 5S6
Bayshore - Toronto Downtown ICN
790 Bay Street
Toronto
Ontario
M5G 1N8
Bayshore - Vaughan ICN
8333 Weston Rd
Woodbridge
Ontario
L4L8E2
Bayshore Infusion Clinic - Brossard
1100 rue du Lux
Brossard
Qubec
J4Y 0E2
Bayshore - Chicoutimi ICN
255 rue racine est
Chicoutimi
Qubec
G7H 7L2
Clinique de perfusion Bayshore - Laval
3300, ave 100 Place Laval 440
Laval
Qubec
H7T 0J7
Clinique de perfusion Bayshore - Montréal (St. Antoine)
450, rue Saint Antoine E, Clinique Médicale Agatha, Suite 510
Montréal
Qubec
H2Y 1A5
Clinique de perfusion Bayshore - Montréal
5100 de Maisonneuve Ouest, Suite 601
Montréal
Qubec
H4A 3T2
Clinique de perfusion Bayshore - Pointe-Claire
955, boulevard St-Jean, Suite 214 (Centre Médical Brunswick)
Pointe-Claire
Qubec
H9R 5K3
Clinique de perfusion Bayshore - Québec City
1200, rue des Soeurs-Du-Bon-Pasteur, GMF Cité-Verte, Bloc Q, Local 220
Québec City
Qubec
G1S 0B1
Bayshore - Roberval ICN
720 boulevard Saint-Joseph
Roberval
Qubec
G8H 2L2
Clinique de perfusion Bayshore - Sherbrooke
360 Galt E, suite 104
Sherbrooke
Qubec
J1G 1X9
Clinique de perfusion Bayshore - Trois-Rivières
1785, boulevard du Carmel, Suite 101B
Trois-Rivières
Qubec
G8Z 3R8
Bayshore - Ste Julie ICN
2105 Armand- Frappier
Ste Julie
Qubec
J3E 2N7
Bayshore - Victoriaville ICN
39 rue Laurier Est
Victoriaville
Qubec
G6P 6P6
Bayshore Infusion Clinic - Regina
2125 11th Ave
Regina
Saskatchewan
S4P 3X3
Coverdale Clinics Medicine Hat
20 Northlands Way NE #108
Medicine Hat
Alberta
T1C 1Z2
Coverdale Clinics Lethbridge
515 7 St S Unit 101
Lethbridge
Alberta
T1J 2G8
Coverdale Clinics Edmonton Hys
Suite 206B, 11010 101 St NW
Edmonton
Alberta
T2V 4R6
Coverdale - Calgary South East
8500 Blackfoot Trail SE Unit 220
Calgary
Alberta
T2J 7E1
Coverdale - Calgary Mission
2303 4th Street SW, Suite 604
Calgary
Alberta
T2S 2S7
Coverdale - Calgary Harvest Hills
178 96 Avenue NE, Suite 213
Calgary
Alberta
T3K 6G4
Coverdale - Airdrie
401 Cooper's Boulevard SW, Suite 1109
Airdrie
Alberta
T4B 4J3
Coverdale - West Edmonton
8944 182nd Street, Suite 222
Edmonton
Alberta
T5T 2E3
Coverdale - South Edmonton
4207 98th Street NW, Suite 102, Greystone Bldg 4
Edmonton
Alberta
T6E 5R7
Coverdale - Fort McMurray
310 Thickwood Boulevard, Unit 1
Fort McMurray
Alberta
T9K 1Y1
Coverdale Clinics Kelowna
1433 St Paul St Suite 208
Kelowna
British Colombia
V1Y 2E4
Coverdale Clinics Burnaby
5050 Kingsway #507
Burnaby
British Colombia
V5H 4C2
Coverdale - Vancouver
750 West Broadway, suite 1400
Vancouver
British Colombia
V5Z 1H2
Coverdale - Richmond
13151 Vanier Place, Suite 180
Richmond
British Colombia
V6V 2J1
Coverdale - Victoria
1175 Cook St, suite 204
Victoria
British Colombia
V8V 4A1
Coverdale Clinics Brandon
2412 Victoria Ave Unit B
Brandon
Manitoba
R7B 0M5
Coverdale - Winnipeg North
109-2110 Main St
Winnipeg
Manitoba
R3G 2V2
Coverdale - Winnipeg Central
1661 Portage Ave, unit 101
Winnipeg
Manitoba
R3J 3T7
Coverdale - Winnipeg South
307-2265 Pembina Highway
Winnipeg
Manitoba
R3T 5J3
Coverdale - Steinbach
380 Stone Bridge Crossing, unit 10
Steinbach
Manitoba
R3T 5J3
Coverdale - Winkler
583 Main St, unit 4 & 5
Winkler
Manitoba
R6W 1A4
Coverdale - Moncton Providence
27 rue Providence, Suite 148
Moncton
New Brunswick
E1C 8X4
Coverdale - Miramichi
250 Pleasant Street, Suite 8
Miramichi
New Brunswick
E1V 1Y5
Coverdale - Tracadie
3980 Rue Principal, Unit 1A
Tracadie-Sheila
New Brunswick
E1X 1B6
Coverdale - Saint John
703 Millidge Ave
Saint John
New Brunswick
E2K 2N7
Coverdale - Fredericton
1015 Regent St, suite 411
Fredericton
New Brunswick
E3B 6H5
Coverdale - St Stephen
89 Prince William St, suite A
St. Stephen
New Brunswick
E3L 1S8
Coverdale - Campbellton
10 Village Ave, suite 16
Campbellton
New Brunswick
E3N 3S8
Coverdale - Edmundston
66 rue Bateman, suite 1
Edmundston
New Brunswick
E3V 0E4
Coverdale Clinics Bathurst
950 Picot Ave
Bathurst
New Brunswick
E2A 4T7
Coverdale Clinics Mount Pearl
30 Mt Carson Ave
Mount Pearl
New Foundland and Labradour
A1N 3K4
Coverdale - St.Johns Stavanger
120 Stavanger Drive, Suite 101
St.Johns
New Foundland and Labradour
A1A 5E8
Coverdale - Gander
60 Memorial Drive
Gander
New Foundland and Labradour
A1V 1C9
Coverdale - Grand Falls-Windsor
28 Cromer Avenue
Grand Falls-Windsor
New Foundland and Labradour
A2A 1X2
Coverdale - Corner Brook
2 Herald Ave, suite 214
Corner Brook
New Foundland and Labradour
A2H 4B5
Coverdale Clinics Sydney River
31 Riverside Dr
Sydney
Nova Scotia
B1S 3N1
Coverdale - Sydney
45 Weatherbee Rd, suite 306A
Sydney
Nova Scotia
B1M 0A1
Coverdale - Antigonish
40 Church St
Antigonish
Nova Scotia
B2G 2C7
Coverdale Clinics Halifax
5991 Spring Garden Rd suite 480
Halifax
Nova Scotia
B3H 1Y6
Coverdale - New Minas
8799 Commercial St
New Minas
Nova Scotia
B4N 3C4
Coverdale Clinics Spryfield
Herring Cove Rd
Halifax
Nova Scotia
B3R 1V9
Coverdale Clinics Bridgewater
Glen Allan Dr
Bridgewater
Nova Scotia
B4V 3N2
Coverdale Clinics Yarmouth
345 Hwy 1 Suite 2A, Dayton
Dayton
Nova Scotia
B5A 5A1
Coverdale Clinics Ottawa East
1900 City Park Dr,
Gloucester
Ontario
K1J 1A3
Coverdale - Ottawa
2039 Robertson Road, unit 505
Ottawa (Nepean)
Ontario
K2H 8R2
Coverdale - Cornwall
171 Montreal Rd, suite 202
Cornwall
Ontario
K6H 1B2
Coverdale - Kingston
1469 Princess St, Unit 3
Kingston
Ontario
K7M 3E9
Coverdale - Belleville
210 Dundas St, suite 205
Belleville
Ontario
K8N 5G8
Coverdale - Peterborough
270 Charlotte St, suite 101
Peterborough
Ontario
K9J 2V4
Coverdale - St. Catharines
245 Pelham Road, Suite 101
St. Catharines
Ontario
L2S 1X8
Coverdale - Orillia
119 Memorial Ave, suite 102
Orillia
Ontario
L3V 5X1
Coverdale - Barrie
1 Quarry Ridge Rd, suite LL1
Barrie
Ontario
L4M 7G1
Coverdale - Mississauga
3420 Hurontario St, suite 202
Mississauga
Ontario
L5B 4A9
Coverdale - Oakville
1393 North Service Rd E, unit 1
Oakville
Ontario
L6H 1A7
Coverdale - Burlington
672 Brant St, suite 401
Burlington
Ontario
L7R 2H3
Coverdale - Hamilton
460 Main Street East, Suite 303
Hamilton
Ontario
L8N 1K4
Coverdale - Scarborough
1371 Neilson Rd, suite 323
Scarborough
Ontario
M1B 4Z8
Coverdale - Toronto NE Allergy
240 Duncan Mill Road
Toronto
Ontario
M3B 3S6
Coverdale - Toronto East - Don Mills
20 Wynford Dr, suite 301
North York
Ontario
M3C 1J4
Coverdale - North York
2065 Finch Ave W, suite 209, 2nd floor
North York
Ontario
M3N 2V7
Coverdale - Toronto Downtown
123 Edward St, Suite 914
Toronto
Ontario
M5G 1E2
Coverdale - Downtown Guelph
21 Surrey St. W
Guelph
Ontario
N1H 3R3
Coverdale Clinics Brampton
Suite 305, 36 Vodden St E
Brampton
Ontario
L6V 4H4
Coverdale - Kitchener-Waterloo
100 Highland Road West, Suite 4
Kitchener
Ontario
N2M 3B5
Coverdale - Woodstock
600 Princess St, suite 302
Woodstock
Ontario
N4S 4H4
Coverdale - London
339 Wellington Road, unit 140
London
Ontario
N6B 5Z9
Coverdale - Windsor Allergy Clinic
1407 Ottawa Street
Windsor
Ontario
N8X 2G1
Coverdale - Windsor
700 Tecumseh Road East, Suite 300
Windsor
Ontario
N8X 4T2
Coverdale - North Bay
1500 Fisher St., Unit 208b
North Bay
Ontario
P1B 2H3
Coverdale - Bracebridge
345 Ecclestone Dr, suite 1053
Bracebridge
Ontario
P1L 1R1
Coverdale - Sudbury
2141 Lasalle Blvd.
Sudbury
Ontario
P3A 2A3
Coverdale - Sault Ste Marie
170 East St, Suite 104
Sault Ste. Marie
Ontario
P6A 3C6
Coverdale - Charlottetown
199 Grafton Street, Suite 303
Charlottetown
Prince Edwards Island
C1A 1L2
Coverdale - Grande-Rivière
200 Grande-Allée Est
Grande-Rivière
Qubec
G0C 1K0
Coverdale - Rivière du Loup
240 rue Lafontaine, suite 102
Rivière-du-Loup
Qubec
G5R 3A7
Coverdale - Trois-Rivières Est
1117 rue Sainte Marguerite
Trois-Rivières
Qubec
G8Z 1Y2
Coverdale - Trois-Rivières
1900 boul des Recollets, suite 120A
Trois-Rivières
Qubec
G8Z 4K4
Coverdale - Montreal West
260 Dunbar Avenue, Suite 100
Mont-Royal
Qubec
H3P 2H5
Coverdale Clinics Jonquiere
3750 Royaume Blvd #200
Jonquière
Qubec
G7X 0A4
Coverdale - Laval
1695 Boul. Laval, Suite 325
Laval
Qubec
H7S 2M2
Coverdale - Contrecoeur
4915 route Marie-Victorin, suite 206
Contrecoeur
Qubec
J0L 1C0
Coverdale Clinics Montreal Centrale
535 Ontario St E
Montreal
Qubec
H1N 1C1
Coverdale - Drummondville
2125 Boul Lemire, Suite 140
Drummondville
Qubec
J2B 8N8
Coverdale - Saint Hyacinthe
2780 Ave Raymond, suite 208
Saint Hyacinthe
Qubec
J2S 5W7
Coverdale - Greenfield Park
4898 Taschereau Boulevard, Suite 101
Greenfield Park
Qubec
J4V 2J2
Coverdale Clinics NDG (Notre-Dame-De-Grace)
5025 Sherbrooke St W
Westmount
Qubec
H4A 1S9
Coverdale - Chateauguay
230 Boul Brisebois, suite 102
Chateauguay
Qubec
J6K 4Y6
Coverdale Clinics Laval Carrefour
3030 Boul. le Carrefour #304
Laval
Qubec
H7T 2P5
Coverdale Clinics Saint Lazare
Suite 210, 1965 Chemin Ste Angélique
Saint-Lazare
Qubec
J7T 0E2
Coverdale - Gatineau
520 Boulevard De l'hôpital, Suite 3C
Gatineau
Qubec
J8V 2P5
Coverdale - Rouyn-Noranda
243 Avenue Murdoch, Suite 106
Rouyn-Noranda
Qubec
J9X 1E8
Coverdale - Regina
1621 Albert St, suite 136
Regina
Saskatchewan
S4P 2S5
Coverdale - Swift Current
244 1st Ave NE, unit 8
Swift Current
Saskatchewan
S9H 2B4
The Catalyst Centre – Oshawa
Taunton Surgical Centre, 1300 Keith Ross Drive
Oshawa
Ontario
L1J 0C7
The Catalyst Centre – Whitby
Whitby Health Centre, 198 Des Newman Drive
Whitby
Ontario
L1P 0P9
Riverside South Medica Centre
665 Earl Armstrong Rd #3
Gloucester
Ontario
K1V 1T4
Charlton Centre Hamilton & Stoney Creek MAIN
Unit # 4, 211 Pritchard Rd
Hamilton
Ontario
L8J 0G5
Charlton Centre Brampton
Suite 301 - 2250 Bovaird Dr E
Brampton
Ontario
L6R 0W3
Charlton Centre Barrie
Suite 300, 15 Gallie Court
Brrie
Ontario
L4M 7G1
Charlton Centre Brantford
D - 17 Corporate Place
Brantford
Ontario
N3R 8A6
Charlton Centre Cambridge
Suite 201 - 745 Coronation Blvd
Cambridge
Ontario
N1R 0B6
Charlton Centre Hamilton Downtown
Suite 403 - 25 Charlton Ave East
Hamilton
Ontario
L8N 1Y2
Charlton Centre Huntsville
Suite 205 - 348 Muskoka Road 3 North
Huntsville
Ontario
P1H 1H8
Charlton Centre Kitchener
Suite 201 - 564 Belmont Ave West
Kitchener
Ontario
N2M 5N6
Charlton Centre Orillia
79 Colborne St East
Orillia
Ontario
L3V 1T6
Charlton Centre Richmond Hill
20 Vogell Road, unit C
Richmond Hill
Ontario
L4B 3L1
Charlton Centre Scarborough
Suite 920-305 Milner Avenue
Scarborough
Ontario
M1B 3V4
Charlton Centre St. Catharines
Suite 5-2 Lakeshore Road
St. Catharines
Ontario
L2N 7E4
Charlton Centre Stoney Creek (part of Hamilton Main)
Unit # 4, 211 Pritchard Rd
Stoney Creek Mtn
Ontario
L8J 0G5
Charlton Centre Sudbury
1935 Paris Street
Sudbury
Ontario
P3E 6C3
Charlton Centre Tecumseh
Suite 20 - 13278 Tecumseh Road East
Tecumseh
Ontario
N8N 3T6
Charlton Centre Timmins
Suite 205, 707 Ross Ave East
Timmins
Ontario
P4N 8R1
Charlton Centre Toronto (Advanced@Charlton)
Suite 105, 700 University Avenue
Toronto
Ontario
M5G 1X6
Charlton Centre Windsor
Suite 500 – 871 Ottawa Street
Windsor
Ontario
N8X 2C9
Dr. Kevin McLeod Inc. Infusion Clinic
101 16th St. West, Suite 200
North Vancouver
British Columbia
V7M 1T3
Care&Family Health - Lawrence Park
6010-3080 Yonge Street
Toronto
Ontario
M4N 3N1
Family Health Hub Walk-in Clinic and Family Practice
190-2525 Old Bronte Rd.
Oakville
Ontario
L6M 4J2
Pearl Family Practice Ridgeway
U-58, 3176 Ridgeway Drive, Mississauga
Mississauga
Ontario
L5L 5S6
PROXIMA Healthcare
101-320 Matheson Blvd West
Mississauga
Ontario
L5R 3R1
Rapid Access IV Iron Clinic
4789 Kingsway, Unit 525
Burnaby
British Columbia
V5H 0A3
RevIVe Iron Clinic
1100 University Ave West
Windsor
Ontario
N9A 5S7
The Gray Clinic
1053 Autumnwood Drive
Winnipeg
Manitoba
R2J 1C6
Total Life Care Medical
7155 Kingsway, Unit 250
Burnaby
British Columbia
V5E 2V1
Vital Health Pharmacy
560 West Avenue
Kelowna
British Columbia
V1Y 4Z4
Vital Health Pharmacy
1825 Fort St.,
Victoria
British Columbia
V8R 1J6
Wellspring Infusion Clinic Abbotsford
2180 Gladwin Rd., Suite 102
Abbotsford
British Columbia
V2S 0H4
Wellspring Infusion Clinic Surrey
12565 88 Avenue, Unit 106
Surrey
British Columbia
V3W 3J7
Wellspring Infusion Clinic Vancouver
943 W Broadway, Unit 510
Vancouver
British Columbia
V5Z 4E1
Stellar Health clinic- Surrey
5633 177B st.
Surrey
British Columbia
V3S 4H9
Cet outil est fourni à titre informatif seulement. CSL Vifor n’est pas responsable des cliniques de perfusion répertoriées ni des services qui y sont fournis. Les renseignements relatifs à l’emplacement des cliniques de perfusion peuvent ne pas être à jour.
Renseignements importants sur l’innocuité
Indications et usage clinique :
FerinjectMD (carboxymaltose ferrique) est indiqué :
- pour le traitement de l’anémie par carence en fer (anémie ferriprive) chez les adultes et les enfants de 1 an et plus lorsque les préparations orales de fer ne sont pas tolérées ou sont inefficaces.
- pour le traitement de la carence en fer chez les adultes atteints d’insuffisance cardiaque de classe II ou III de la New York Heart Association (NYHA) afin d’améliorer la capacité à l’effort.
Le diagnostic de carence en fer doit reposer sur des analyses de laboratoire.
Contre-indications :
FerinjectMD est contre-indiqué chez les patients qui :
- présentent une hypersensibilité significative connue à d’autres produits parentéraux contenant du fer;
- présentent une anémie non liée à une carence en fer (p. ex., autre anémie microcytaire);
- présentent des signes et symptômes de surcharge en fer ou des troubles d’utilisation du fer (p. ex., hémochromatose, hémosidérose).
Mises en garde et précautions les plus importantes :
Réactions d’hypersensibilité : FerinjectMD est contre-indiqué chez les patients qui présentent une hypersensibilité au produit, à un ingrédient de la préparation, y compris à un ingrédient non médicinal, ou à un composant du contenant.
- De graves réactions d’hypersensibilité, y compris des anaphylaxies et réactions anaphylactoïdes mettant la vie en danger et fatales, ont été signalées chez des patients recevant des produits contenant du fer i.v., y compris FerinjectMD.
- La surveillance des patients, y compris de la pression artérielle et du pouls, est recommandée afin de détecter tout signe et symptôme de réaction d’hypersensibilité au cours de chaque perfusion de FerinjectMD et pendant au moins les 30 minutes qui suivent.
- FerinjectMD doit être administré seulement lorsque le personnel et les traitements nécessaires à la prise en charge de l’anaphylaxie et d’autres réactions d’hypersensibilité sont accessibles immédiatement.
Autres mises en garde et précautions pertinentes :
- Accumulation de fer dans des sites de dépôt et hémosidérose potentielle causées par l’administration excessive de fer parentéral : on recommande de surveiller régulièrement la réponse hématologique et les paramètres du fer, comme le taux de ferritine sérique et le coefficient de saturation de la transferrine (CST).
- Hypophosphatémie et ostéomalacie hypophosphatémique : on recommande de surveiller les taux de phosphate sérique chez les patients présentant des facteurs de risque, y compris ceux qui ont besoin d’un traitement répété, ainsi que chez tous les patients qui reçoivent un deuxième traitement dans les trois mois qui suivent le traitement initial.
- Risque chez les patients présentant une insuffisance hépatique et les patients atteints d’insuffisance hépatique chez qui la surcharge en fer constitue un facteur précipitant, plus particulièrement la porphyrie cutanée tardive.
- Réactions d’hypersensibilité : on recommande de surveiller l’apparition de signes et symptômes d’une réaction pendant chaque administration et pendant au moins les 30 minutes qui suivent.
- Infection.
- Extravasation (fuite paraveineuse).
- Données cliniques sur l’utilisation chez des femmes enceintes limitées : le traitement ne doit être utilisé qu’à partir de la 16e semaine de grossesse.
- Bradycardie fœtale (généralement transitoire) : on recommande de surveiller l’enfant à naître pendant l’administration à des femmes enceintes.
- Effets indésirables potentiels chez les nourrissons allaités par des femmes qui prennent FerinjectMD pendant l’allaitement : il faut soupeser les bienfaits de l’allaitement pour le développement et la santé, la nécessité clinique pour la mère de prendre FerinjectMD et les risques pour le nourrisson allaité d’effets indésirables associés au médicament ou à la maladie sous-jacente de la mère.
Pour de plus amples renseignements :
Veuillez consulter la monographie du produit pour obtenir des renseignements importants sur les réactions indésirables, les interactions médicamenteuses et les renseignements posologiques qui ne sont pas abordés dans la présente.
Vous pouvez également obtenir la monographie en écrivant à medinfo.canada@viforpharma.com ou en composant le 1-866-773-7721 durant les heures d’ouverture normales ou le 514-219-7560 en cas d’urgence ou en-dehors des heures d’ouverture normales.
Références & notes de bas de page
Référence
- Monographie de FerinjectMD. Vifor (International) Inc. 27 juin 2024.
Tout effet indésirable doit être signalé. Vous pouvez signaler à Santé Canada tout effet indésirable qui pourrait être lié à un produit de santé :
- en visitant le site Web des déclarations des effets indésirables pour vous informer sur comment faire une déclaration en ligne, par courriel, ou par télécopieur; ou
- en téléphonant sans frais au 1-866-234-2345.
Les effets indésirables doivent également être signalés à CSL Behring Canada (AdverseReporting@cslbehring.com).
Gardez le contact
Inscrivez-vous à notre liste de diffusion pour recevoir des mises à jour sur FerinjectMD et les ressources qui s’offrent à vous et à vos patients.
Inscrivez-vous dès maintenantDemandez de l’aide de CSL
Présentez une demande de subvention ou de don à CSL ici.
Entamez une demande